Un biomarqueur de la dégénescence cognitive identifié à partir de lIRM cérébrale
Des chercheurs chinois ont développé un modèle de prédiction de l'âge du cerveau basé sur l'intelligence artificielle (IA) pour quantifier les écarts observés par rapport à une trajectoire saine de vieillissement cérébral chez les patients atteints de troubles cognitifs légers. Dans une étude publiée dans la Revue Radiology: Artificial Intelligence, ils montrent que ce modèle a le potentiel d'aider à la détection précoce des troubles cognitifs au niveau individuel.
La déficience cognitive amnésique légère (aMCI) est une phase de transition entre le vieillissement cérébral normal et la maladie d'Alzheimer (MA). Les personnes atteintes d'aMCI ont des déficits de mémoire qui sont plus graves que la normale pour leur âge et leur statut, mais pas assez graves pour affecter leur activité quotidienne.
Une étude à grande échelle à partir de l'IRM cérébrale en T1
À l’occasion d’une étude, qui est parue dans la Revue Radiology, le Pr, Ni Shu, du State Key Laboratory of Cognitive Neuroscience and Learning de la Beijing Normal University, (Pékin, Chine) et ses collègues ont utilisé un algorithme d’apprentissage automatique pour former un modèle de prédiction de l'âge du cerveau basé sur des images IRM pondérées en T1 de 974 adultes en bonne santé âgés de 49,3 à 95,4 ans. Le modèle, une fois entraîné, a été appliqué pour estimer la différence d'âge prévue (âge prévu par rapport à l'âge réel) des patients aMCI de la Beijing Aging Brain Rejuvenation Initiative (616 témoins sains et 80 patients aMCI) et de l'Alzheimer's Disease Neuroimaging Initiative (589 témoins sains et 144 patients aMCI).
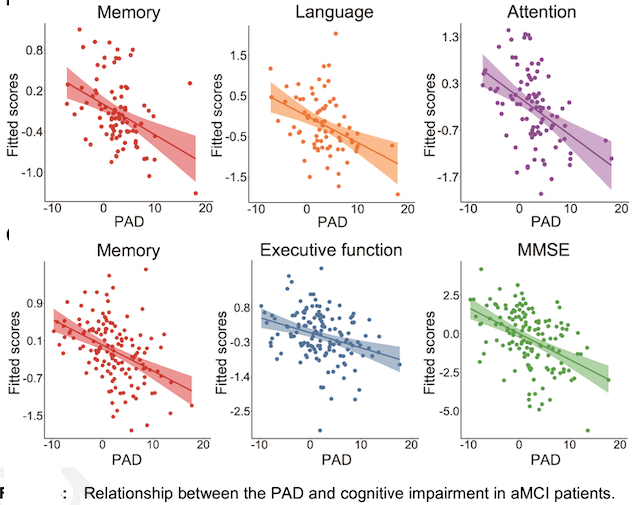 Les chercheurs ont également examiné les associations entre la différence d'âge prévue et les troubles cognitifs, les facteurs de risque génétiques, les biomarqueurs pathologiques de la MA et la progression clinique chez les patients aMCI. Les résultats ont montré que les patients aMCI avaient des trajectoires de vieillissement cérébral distinctes de la trajectoire de vieillissement normale typique, et le modèle de prédiction de l'âge cérébral proposé pourrait quantifier les écarts individuels par rapport à la trajectoire de vieillissement normale typique chez ces patients. La différence d'âge prédite s’est, d’autre part, avérée significativement associée à une déficience cognitive individuelle des patients aMCI dans plusieurs domaines, notamment la mémoire, l'attention et la fonction exécutive.
Les chercheurs ont également examiné les associations entre la différence d'âge prévue et les troubles cognitifs, les facteurs de risque génétiques, les biomarqueurs pathologiques de la MA et la progression clinique chez les patients aMCI. Les résultats ont montré que les patients aMCI avaient des trajectoires de vieillissement cérébral distinctes de la trajectoire de vieillissement normale typique, et le modèle de prédiction de l'âge cérébral proposé pourrait quantifier les écarts individuels par rapport à la trajectoire de vieillissement normale typique chez ces patients. La différence d'âge prédite s’est, d’autre part, avérée significativement associée à une déficience cognitive individuelle des patients aMCI dans plusieurs domaines, notamment la mémoire, l'attention et la fonction exécutive.
Un authentique biomarqueur pour prédire l'émergence de troubles cognitifs et d'Alzheiumer
"Le modèle prédictif que nous avons généré était très précis pour estimer l'âge chronologique des participants en bonne santé en se basant uniquement sur les images IRM, ont rapporté les chercheurs. En revanche, pour l'aMCI, le modèle a estimé que l'âge du cerveau était supérieur de 2,7 ans en moyenne à l'âge chronologique du patient."
Le modèle a en outre montré que les patients faisant l’objet d’une aMCI qui évolue présentent plus d'écarts par rapport au vieillissement normal typique que les patients aMCI stables, et que l'utilisation du score de différence d'âge allié à d'autres biomarqueurs spécifiques à la MA pourrait mieux prédire la progression de l'aMCI. Les porteurs d'apolipoprotéine E (APOE) ε4 ont montré des différences d'âge prédites plus importantes que les non-porteurs, et les patients positifs à l'amyloïde ont montré des différences d'âge prédites plus importantes que les patients négatifs à l'amyloïde.
La combinaison de la différence d'âge prédite avec d'autres biomarqueurs de la MA a montré la meilleure performance pour différencier l'aMCI progressive de l'aMCI stable. "Ce travail indique que la différence d'âge prédite a le potentiel d'être un biomarqueur robuste, fiable et numérique pour le diagnostic précoce des troubles cognitifs et le suivi de la réponse au traitement", ont conclu les auteurs.
SUR LE MÊME THÈME


Iconographie radiologique du cerveau modifié par les substances psychoactives
La Revue Radiology présente une iconographie radiologique des répercussions cérébrales de la prise régulière de substances psychoactives. Un article qui s’adresse plus particulièrement aux radiologues qui exercent aux urgences.
09/02/2026 -


Évolution de la charge de travail en neuroradiologie d'urgence depuis quinze ans
La conjoncture démographique du secteur fait craindre une surutilisation de la neuroradiologie en périodes de garde. Ce secteur, qui semble peu impacté par la hausse du nombre d’examens négatifs, fait l’objet d’une charge de travail en hausse de 130% en TDM neuroradiologique d'urgence, selon une étu...
15/01/2026 -


Diagnostic de la SEP : les nouveaux critères de McDonald passés au crible
Le Syndrome radiologiquement isolé est le premier signe avant-coureur de la SEP en IRM. Ce syndrome est synthétisé dans les Critères de McDonald, qui a fait l’objet d’une mise à jour en 2004 avec de nouvelles implications cliniques et radiologiques. Un article publié dans l’American Journal of Roent...
26/12/2025 -

Le RSNA AI Challenge 2025 a rendu son verdict
La Radiological Society of North America (RSNA) a annoncé, en amont de son congrès annuel, les résultats du Challenge AI 2025 de la RSNA sur la détection des anévrismes intracrâniens.
15/12/2025 -


La TEP amyloïde révèle des biomarqueurs de l'Alzheimer chez les patients obèses
Des chercheurs ont présenté, à l’occasion du congrès de la RSNA 2025, la première étude évaluant l'impact de l'obésité sur les biomarqueurs sanguins de la maladie d'Alzheimer. En utilisant la TEP amyloïde, ils ont confirmé l’augmentation de ces biomarqueurs jusqu'à 95 % plus rapide chez les personne...
11/12/2025 -

L'IRM fonctionnelle explique les comportements fanatiques à travers celui des supporters de football
En étudiant l'activité cérébrale des supporters de football par IRM fonctionnelle, des chercheurs ont découvert que certaines régions du cerveau s'activaient lors du visionnage de matchs de leur équipe favorite, déclenchant des émotions et des comportements positifs et négatifs. Dans un article publ...
18/11/2025 -


Des protocoles de tractographie IRM, un espoir pour mieux explorer le cerveau dans le maladie d'Alzheimer
La tractographie par IRM devient un outil pertinent pour évaluer les flux dans les faisceaux de fibres cérébrales. Une étude italienne publiée dans la Revue European Radiology explore la complexité du faisceau cingulaire par tractographie probabiliste et expérimente plusieurs protocoles d’acquisitio...
04/11/2025 -
LETTRE D'INFORMATION
Ne manquez aucune actualité en imagerie médicale et radiologie !
Inscrivez-vous à notre lettre d’information hebdomadaire pour recevoir les dernières actualités, agendas de congrès, et restez informé des avancées et innovations dans le domaine.


